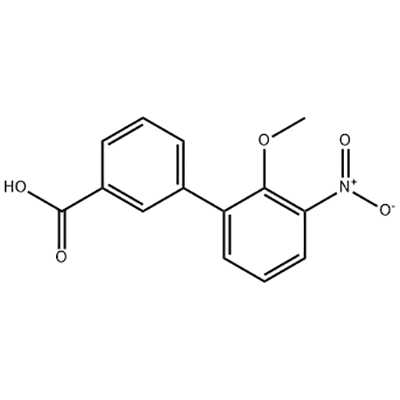
2'-Methoxy-3'-nitro-biphenyl-3-carboxylic acid
2'-Methoxy-3'-nitro-biphenyl-3-carboxylic acid
2'-Methoxy-3'-nitro-biphenyl-3-carboxylic acid wurdt brûkt as it intermediate fan Eltrombopag.
Eltrombopag, ûntwikkele troch GlaxoSmithKline (GSK) yn it Feriene Keninkryk en letter tegearre ûntwikkele mei Novartis yn Switserlân, is de earste en ienige goedkarde lytse molekule net-peptide TPO receptor agonist yn 'e wrâld.Eltrombopag waard goedkard troch de US FDA yn 2008 foar de behanneling fan idiopatyske thrombocytopenyske purpura (ITP), en yn 2014 foar de behanneling fan slimme aplastyske anemia (AA).It is ek it earste medisyn goedkard troch de US FDA foar de behanneling fan AA yn 'e lêste 30 jier.
Yn desimber 2012 hat de US FDA Eltrombopag goedkard foar de behanneling fan thrombocytopenia yn pasjinten mei chronike hepatitis C (CHC), sadat hepatitis C-pasjinten mei in minne prognoaze fanwegen leech oantal bloedplaatjes kinne begjinne en ûnderhâlde interferon basearre standert terapy foar leversykten.Op febrewaris 3, 2014, kundige GlaxoSmithKline oan dat de FDA de trochbraakbehanneling-medisynkwalifikaasje fan Eltrombopag ferliende foar de behanneling fan hemopenia yn pasjinten mei slimme chemicalbook aplastyske anemia (SAA) dy't net folslein reagearren op immunotherapy.Op 24 augustus 2015 hat de US FDA Eltrombopag goedkard foar de behanneling fan thrombocytopenia yn folwoeksenen en bern fan 1 jier en âlder mei chronike immune thrombocytopenia (ITP) dy't net genôch antwurd hawwe op corticosteroids, immunoglobulins of splenektomy.Op 4 jannewaris 2018 waard Eltrombopag goedkard om te wurde fermeld yn Sina foar de behanneling fan primêre immune thrombocytopenia (ITP).



![pentamethylene bis[1-(3,4-dimethoxybenzyl)-3,4-dihydro-6,7-dimethoxy-1H-isoquinoline-2-propionate], dioxalate](http://cdn.globalso.com/jindunchem-med/image281-300x300.png)

![Casp ungin Acetate;Caspofunginacetate;Cancidas;Caspofunginacetate [USAN:BAN:JAN];](http://cdn.globalso.com/jindunchem-med/fbe17385-300x300.jpg)